ДВС-синдром: тромбоз vs кровотечение
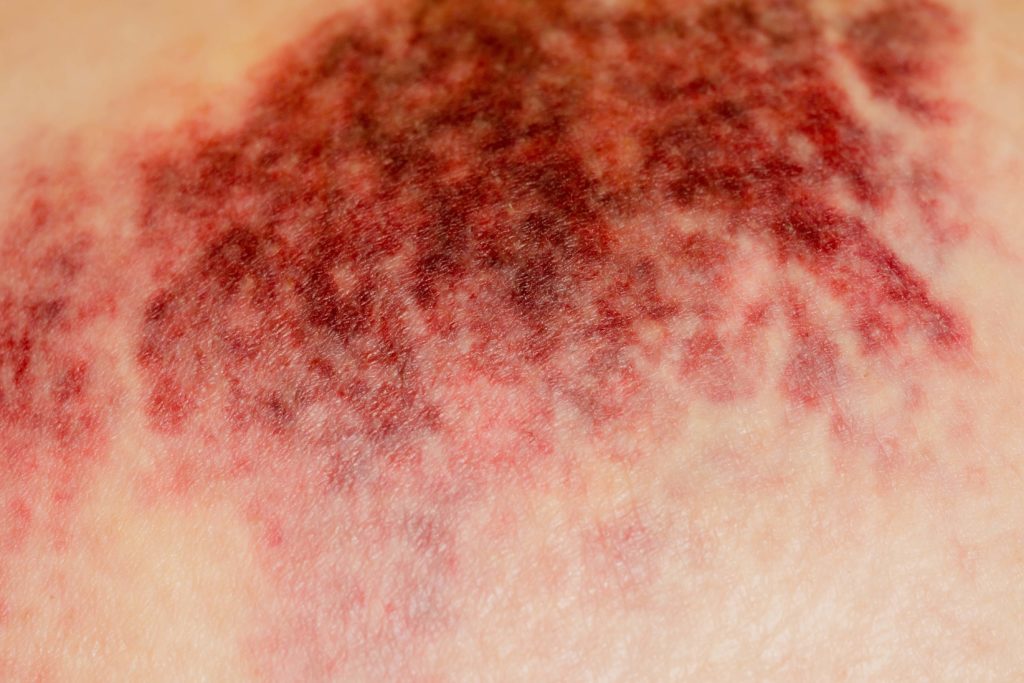
ДВС-синдром – это сложное приобретенное системное нарушение процесса гемостаза в организме, которое включает сочетание кровотечения и микрососудистой коагуляции. Международное общество тромбоза и гемостаза (ISTH) определяет ДВС-синдром как «приобретенный синдром, характеризующийся внутрисосудистой активацией свертывания крови». При ДВС-синдроме развиваются нарушения микроциркуляции, что может привести к органной дисфункции. Диссеминированное внутрисосудистое свертывание крови (ДВС) – это чрезмерное образование тромбина и фибрина в периферической циркулирующей крови, что ассоциировано с увеличением агрегации тромбоцитов и потребления факторов свертывания крови.
Чем опасен ДВС-синдром?
Медленно развивающийся ДВС-синдром (в течение недель или месяцев) чаще всего осложняется венозным тромбозом и эмболией; быстро развивающийся ДВС-синдром (в течение нескольких часов или дней) осложняется развитием кровотечений. Чаще всего врачи рассматривают возможность наличия ДВС-синдрома только в тяжелых случаях, неконтролируемого кровотечения из нескольких участков.
Какой механизм развития ДВС-синдрома?
Двумя ключевыми факторами, ответственными за развитие ДВС-синдрома, являются циркулирующий плазмин и тромбин. ДВС-синдром – это повторяющийся цикл образования сгустка и фибринолиза сгустка, приводящий к истощению тромбоцитов и факторов свёртывания, включая постоянное высвобождение факторов антикоагуляции. По мере снижения уровня тромбоцитов в системном микроциркуляторном русле происходит коагуляция. Образующиеся сгустки препятствуют циркуляции крови. Прекращение нормального кровоснабжения жизненно важных органов может привести к их серьезному повреждению. В то же время истощение количества тромбоцитов и белков свёртывания приводит к провоцированию сильных кровотечений. Пациенты с ДВС-синдромом со сниженным уровнем тромбоцитов и факторов коагуляции могут подвергаться риску серьезного кровотечения при прохождении инвазивных хирургических процедур. Кроме того, антитромбин, важный ингибитор действия тромбина снижается из-за его постоянного потребления продолжающейся активацией коагуляции; избыток тромбина отрицательно влияет на эндотелий сосудов, вызывая нарушения его функции, ведущей к вазогенному отеку. Низкие уровни антитромбина при ДВС-синдроме связаны с увеличением смертности.
Таким образом, беспрепятственное производство плазмина и тромбина приводит к следующим осложнениям:
- Генерализованное системное кровотечение.
- Избыточное производство продуктов распада фибрина, включая D-димеры.
- Истощение антикоагулянтных белков, включая антитромбин и белок C.
- Активация и истощение тромбоцитов, факторов свёртывания, фибриногена и фибрина.
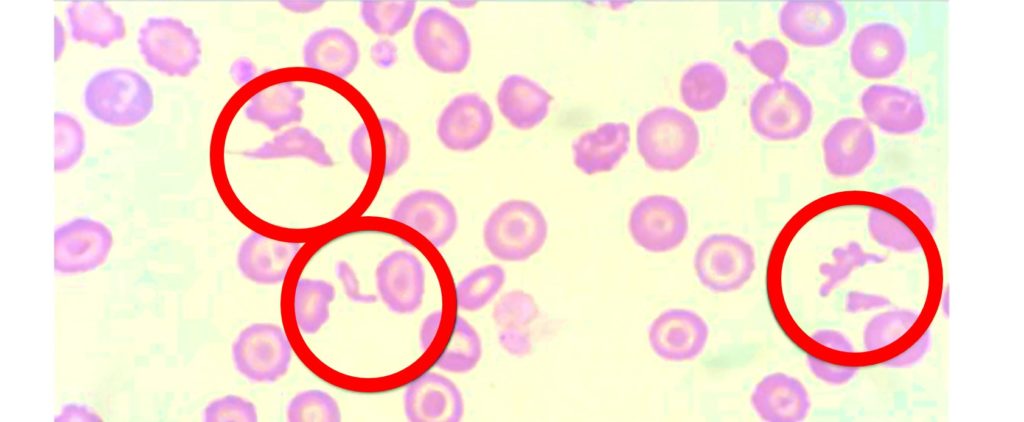
- Образование шистоцитов, когда красные кровяные тельца повреждаются по мере движения через нити фибрина. Шистоциты (шизоциты) – это фрагментированные эритроциты, которые напоминают осколки, каски, треугольники. Шистоциты никогда не являются артефактом в мазках и имеют важное диагностическое значение. Шистоциты образуются в результате фрагментации эритроцитов при механической травме клеток, происходящей при их движении по сосудам неправильной формы или по сосудам с турбулентными потоками крови. Когда эритроциты ударяются о стенки сосудов, происходит их фрагментация, фрагменты неустойчивы в кровеносном русле, в дальнейшем быстро разрушаются.
- Образование микротромбов, которые блокируют кровеносные сосуды, препятствуя поступлению крови и кислорода, приводит к ишемии тканей и возможному синдрому полиорганной дисфункции.
ДВС-синдром возникает в результате контакта тканевого фактора с кровью, что запускает коагуляционный каскад, активацию фибринолитического пути. Стимуляция эндотелиальных клеток сосудистого русла цитокинами и нарушение микроваскулярного кровотока вызывает высвобождение тканевого активатора плазминогена (ТАП) из эндотелиальных клеток. ТАП, в свою очередь, а также плазминоген прикрепляются к полимерам фибрина. Плазмин, который образуется в результате расщепления плазминогена под действием ТАП, расщепляет фибрин до D-димеров и других продуктов деградации фибрина. Именно поэтому, ДВС-синдром может вызывать как тромбоз так и кровотечение (при наличии чрезмерного потребления тромбоцитов и/или факторов свертывания крови).
Какие причины развития ДВС-синдрома?
Примерно у 1% госпитализированных пациентов развивается ДВС-синдром, у 20% пациентов с острым респираторный дистресс-синдром (ОРДС) развивает ДВС-синдром. Сепсис является наиболее частой причиной развития ДВС-синдрома. Примерно у 35% пациентов с сепсисом развивается ДВС-синдром.
Этиологические причины ДВС-синдрома:
| Инфекционно-септические: | – бактериальные; – вирусные; – токсически-шоковый (в том числе при абортах). Инфекции, особенно вызванные грамотрицательными микроорганизмами: грамотрицательный эндотоксин вызывает выработку или активирует тканевые факторы в фагоцитарных, эндотелиальных и тканевых клетках. |
| Травматические при деструкциях тканей: | – ожоговый; – синдром длительного сдавления; – массивные травмы; – при некрозах тканей и органов (острая токсическая дистрофия печени, некротический панкреатит, острый инфаркт миокарда и др.); – при остром внутрисосудистом гемолизе, в том числе при переливаниях несовместимой крови;при травматичных операциях; – при массивных гемотрансфузиях; – при гемобластозах, прежде всего при остром промиелоцитарном лейкозе;при острой лучевой болезни. Реакция на любые условия, которые вызывают ишемические повреждения тканей, высвобождение тканевого фактора. |
| Осложнения при родах | – при эмболии околоплодными водами (особенно инфицированными); – при ранней отслойке и предлежании плаценты; – при атонии и массаже матки;индуцированный солевым раствором аборт по медицинским показаниям;при внутриутробной гибели плода и его ретенции; – при преэклампсии и эклампсии. Плацентарная ткань с активным тканевым фактором входит в контакт или циркулирует в крови матери. |
| Шоковые | При всех терминальных состояниях. |
| Онкологический процесс | – Злокачественные новообразования (в особенности муцинозная аденокарцинома поджелудочной железы, аденокарцинома предстательной железы и острый промиелоцитарный лейкоз). – В процессе интенсивной химиотерапии. Опухолевые клетки экспрессируют и выделяют (или высвобождают) тканевой фактор. |
| Более редкие причины: | – При трансплантации органов. – Осложнения операции на предстательной железе, при которых возможно попадание в кровоток ткани предстательной железы, которая имеет активность тканевого фактора (наряду с активаторами плазминогена). – Ферменты определенных змеиных ядов, которые попадают в кровяное русло, активируют один или несколько факторов свертывания крови, либо генерируют тромбин, либо непосредственно превращают фибриноген в фибрин. – Массивный внутрисосудистый гемолиз. – Аневризмы аорты или кавернозные гемангиомы (синдром Казабаха-Мерритта), связанные с повреждением стенки сосудов и зонами стаза крови |
Как распознать развитие ДВС-синдрома?
Диагноз ДВС-синдрома основывается как на клинических симптомах, так и на лабораторных данных.
Развитие ДВС-синдрома следует подозревать у больных с кровотечением неизвестной этиологии или венозной тромбоэмболией, особенно при наличии предрасполагающей патологии (см. табл. Этиологические причины ДВС-синдрома).
Стадии развития ДВС-синдрома:
I стадия — гиперкоагуляции;
II стадия — гипокоагуляции;
III стадия — гипокоагуляции с генерализованной активацией фибринолиза;
IV стадия — полное несвертывание крови.
Не существует единого лабораторного теста, который можно было бы использовать для диагностики или исключение диагноза ДВС-синдрома. Цели тестов – выявить ДВС, оценить степени тяжести и отслеживать его последствия с течением времени. Часто проводится комбинация тестов, которые выполняются с интервалами для тщательного наблюдения за пациентом на предмет клинического улучшения или ухудшения.
Если у пациента подозревают ДВС-синдром, то необходимо провести:
- Общий анализ крови с оценкой количества тромбоцитов;
- Определение D-димера;
- Анализ крови на фибриноген;
- Протромбиновое время (ПВ);
- Продукты распада фибрина;
- Частичное тромбопластиновое время (ЧТВ).
Система оценки ДВС-синдрома, разработанная Международным обществом по тромбозам и гемостазу – это система, наиболее часто используемая врачами для оценки результатов тестов для определения наличия ДВС-синдрома.
Оценка основана на результатах определения D-димера, фибриногена, тромбоцитов, протромбинового время. Чем выше оценка, тем выше вероятность наличия ДВС-синдрома.
Помимо балльной системы, также может использоваться для диагностики ДВС-синдрома:
- Удлинение протромбинового времени;
- Наличие продуктов распада фибрина в плазме;
- Продолжительное активированное частичное тромбопластиновое время (ЧТВ);
- Распознавание основного состояния, связанного с ДВС-синдромом;
- Низкий уровень ингибиторов свертывания крови, таких как антитромбин, в плазме крови;
- Количество тромбоцитов менее 100,000 на кубический миллиметр или быстро уменьшающееся количество тромбоцитов.
Снижение количества тромбоцитов или уменьшение количества тромбоцитов по сравнению с повторным лабораторным измерением является чувствительным, но не специфическим индикатором ДВС-синдрома. Тромбоцитопения – выявляется в 98% случаев ДВС-синдрома. Продукты распада фибрина в сочетании с уменьшением количества тромбоцитов являются сильным индикатором ДВС-синдрома. Кроме того, протромбиновое время удлиняется примерно в 50% – 60% случаев ДВС-синдрома.
Также выделяют следующие типы ДВС-синдрома:
- OF – тип органной недостаточности ДВС-синдрома;
- BL – кровоточащий тип ДВС-синдрома;
- MB – массивный кровоточащий тип ДВС-синдрома;
- NS – бессимптомный тип ДВС-синдрома.
Лабораторные тесты при ДВС-синдроме:
| Изменение при ДВС-синдроме | Другие причины изменения | Типы ДВС-синдрома | |
| Протромбиновое время | Пролонгировано | Нарушение функции печени, дефицит витамина К. | – OF – тип органной недостаточности ДВС-синдрома; – BL – кровоточащий тип ДВС-синдрома; – MB – массивный кровоточащий тип ДВС-синдрома |
| Продукты распада фибрина; D-димер | Повышены | Венозная тромбоэмболия, операция | – OF – тип органной недостаточности ДВС-синдрома; – BL – кровоточащий тип ДВС-синдрома; – NS – бессимптомный тип ДВС-синдрома |
| Фибриноген | Снижен | Нарушение функции печени | – BL – кровоточащий тип ДВС-синдрома; – MB – массивный кровоточащий тип ДВС-синдрома |
| Количество тромбоцитов | Снижено | Заболевания костного мозга | – OF – тип органной недостаточности ДВС-синдрома; – BL – кровоточащий тип ДВС-синдрома; – MB – массивный кровоточащий тип ДВС-синдрома; – NS – бессимптомный тип ДВС-синдрома |
| Антитромбин / протеин C | Снижены | Нарушение функции печени, синдром капиллярной утечки – Capillary leak syndrome | OF – тип органной недостаточности ДВС-синдрома |
| Растворимый фибрин/ комплекс тромбин-антитромбин | Повышены | Венозная тромбоэмболия, операция | – OF – тип органной недостаточности ДВС-синдрома; – BL – кровоточащий тип ДВС-синдрома; – MB – массивный кровоточащий тип ДВС-синдрома; – NS – бессимптомный тип ДВС-синдрома |
| Тромбомодулин | Повышен | Почечная дисфункция, органная недостаточность | OF – тип органной недостаточности ДВС-синдрома |
| Пропептид фактора фон Виллебранда, ингибитор активатора плазминогена-I | Повышены | органная недостаточность | OF – тип органной недостаточности ДВС-синдрома |
| ADATMTS13 | Снижен | Нарушение функции печени, тромботическая микроангиопатия | OF – тип органной недостаточности ДВС-синдрома |
| Активированное частичное тромбопластиновое время | Двухфазная форма волны | Инфекция | OF – тип органной недостаточности ДВС-синдрома |
| Плазмин-плазмин ингибирующий комплекс | Повышение | Венозная тромбоэмболия, операция | – BL – кровоточащий тип ДВС-синдрома; – MB – массивный кровоточащий тип ДВС-синдрома |
Признаки и симптомы зависят от основного заболевания, но общие клинические особенности ДВС-синдрома включают:
- петехии;
- гематурия;
- гипотония;
- самопроизвольное появление гематом;
- кровотечение из дыхательных путей;
- кровотечение слизистой оболочки десен, рта, носа;
- возможно кровотечение в местах венепункции / внутривенного катетера;
- тромбозы периферических артерий, конечности холодные на ощупь и отсутствие пульса, симптомы ТЭЛА;
- кровотечение из области хирургической раны, например кровотечение из ЦНС, желудочно-кишечного тракта.
Клиническая симптоматика может зависеть от того, медленно или быстро развивается ДВС-синдром:
| Характеристика | Медленно-развивающийся ДВС-синдром | Тяжелый, быстро развивающийся ДВС-синдром |
| Клинические проявления | Симптомы венозного тромбоза и/или симптомы тромбоэмболии легочных артерий. | Места проколов кожи (например, внутривенные или артериальные проколы) могут сильно кровоточить, на местах парентеральных инъекций могут появляться гематомы, а также может развиться острое желудочно-кишечное кровотечение. |
| Лабораторные данные | – Лёгкая тромбоцитопения; – От нормальных до минимальной продолжительности показателей протромбинового время (результаты, как правило, представлены МНО и ЧТВ – Уровень фибриногена в норме или умеренно снижен (различные заболевания стимулируют повышенный синтез фибриногена как вещества острой фазы, снижение уровня фибриногена в двух последовательных измерения может помочь определить ДВС-синдром). – Повышенный уровень D-димера в плазме | – Более тяжелая форма тромбоцитопении – Удлинение протромбинового времени и частичного тромбопластинового времени – Быстро снижающийся уровень фибриногена в плазме – Высокий уровень D-димера в плазме – Определение уровня фактора VIII иногда может быть полезным при необходимости дифференцировать тяжелый, острый ДВС-синдром от массивным некрозом печени, который может вызывать аналогичные отклонения в коагулограмме. Уровень фактора VIII повышается при некрозе печени, так как фактор VIII вырабатывается в клетках эндотелия печени и высвобождается по мере их разрушения; уровень фактора VIII снижается при ДВС-синдроме из-за вызванного тромбином образования активированного протеина С, который протеолизует активированную форму фактора VIII. |
В клинической картине ДВС-синдрома отмечаются:
в 1-й стадии — симптомы основного заболевания и признаки тромбогеморрагического синдрома (с преобладанием проявлений генерализованного тромбоза), гиповолемия, нарушение метаболизма;
во 2-й стадии появляются признаки полиорганного повреждения и блокады системы микроциркуляции паренхиматозных органов, геморрагический синдром (петехиально-пурпурный тип кровоточивости);
в 3-й стадии к указанным нарушениям присоединяются признаки полиорганной недостаточности (острая дыхательная, сердечно-сосудистая, печеночная, почечная, парез кишечника) и метаболические нарушения (гипокалиемия, гипопротеинемия, метаболический синдром по смешанному типу (петехии, гематомы, кровоточивость из слизистых оболочек, массивные желудочно-кишечные, легочные, внутричерепные и другие кровотечения, кровоизлияния в жизненно важные органы);
в 4-й стадии (при благоприятном исходе) основные витальные функции и показатели гемостаза постепенно нормализуются.
Как лечить ДВС-синдром?
Специального лечения ДВС-синдрома не существует. Основная цель лечения– быстро определить и лечить этиологическую причину, чтобы ограничить избыточное образование тромбина и стабилизировать пациента.
Как можно скорее должна быть проведена борьба с причиной возникновения заболевания (например, лечение грамотрицательного сепсиса антибиотиком широкого спектра или антибиотиками резерва, вычищение матки при преждевременной отслойке плаценты). Если этиологическое лечение эффективно, то синдром диссеменированного внутрисосудистого свертывания должен разрешиться.
Лечение ДВС-синдрома определяется его клиническим проявлением (медленно-развивающийся ДВС-синдром или тяжелый, быстро развивающийся ДВС-синдром).
Если у пациента имеется тяжелое кровотечение с критической локализацией (например, головной мозг, желудочно-кишечный тракт), или если есть неотложная необходимость проведения хирургического вмешательства, то назначают дополнительную заместительную терапию.
Заместительная терапия может проводиться:
| Вид заместительной терапии | Цель | Условие |
| Тромбоконцентрат | для коррекции тромбоцитопении | в случае быстрого снижения количества тромбоцитов или количества тромбоцитов < 10000-20000/мкл [< 10-20 ×109/л] |
| Криопреципитатом | для восполнения фибриногена (и фактора VIII) | если уровень фибриногена быстро снижается или составляет < 100 мг/дл (< 2,9 мкмоль/л). |
| Свежезамороженная плазма | для повышения уровня других факторов свертывания и естественных антикоагулянтов (антитромбина, протеинов C, S, и Z) | удлинение протромбинового времени и частичного тромбопластинового времени |
Медленно развивающийся ДВС-синдром
Пациенты с ДВС-синдромом с высоким риском венозной тромбоэмболии могут получать низкомолекулярные гепарины. Гепарин рекомендуется пациентам с бессимптомным типом ДВС-синдрома, чтобы предотвратить тромбоз глубоких вен.
Было опубликовано три руководства по диагностике и лечению ДВС-синдрома Британского комитета по стандартам в гематологии (BCSH), Японского общества тромбозов и гемостаза (JSTH) и Итальянского общества тромбозов и гемостаза (SISET). Хотя эти три руководства во многом схожи, есть различия в некоторых рекомендациях относительно лечения ДВС-синдрома. Поэтому подкомитет по ДВС Комитета по науке и стандартизации (SSC) / Международного общества тромбоза и гемостаза (ISTH) согласовал эти три руководства в отчете, озаглавленном «Руководство по диагностике и лечению ДВС на основе гармонизации рекомендаций трех руководств».
| BCSH | JSTH | SISET | ISTH/SSC | |
| Балльная оценка наличия ДВС-синдрома | Рекомендована | Может быть рассмотрена | Рекомендована | Рекомендована (рекомендации высокой степени доказательности) |
| Проведение единичного теста для определения ДВС-синдрома | Не рекомендован | Не рекомендован | Не рекомендован | Рекомендована (рекомендации высокой степени доказательности) |
| Лечение причинного заболеавния | Рекомендовано | Рекомендовано | Рекомендовано | Рекомендовано (рекомендации умеренной степени доказательности) |
| Определение уровня тромбоцитов | Рекомендовано | Рекомендовано | Рекомендовано | Рекомендовано (рекомендации низкой степени доказательности) |
| Свежезамороженная плазма | Рекомендовано | Рекомендовано | Рекомендовано | Рекомендовано (рекомендации низкой степени доказательности) |
| Фибриноген, криопреципитат | Рекомендовано | Не согласие | Рекомендовано | Рекомендовано (рекомендации низкой степени доказательности) |
| Активированный фактор свертывания VIIa | Не согласие | Не согласие | Не рекомендовано | Не упоминается |
| Нефракционированный гепарин (для лечения) | Рекомендовано | Рекомендовано | Не рекомендовано | Рекомендовано (рекомендации низкой степени доказательности) |
| Нефракционированный гепарин (для профилактики ВТЭ) | Рекомендовано | Не согласие | Рекомендовано | Рекомендована (рекомендации высокой степени доказательности) |
| Низкомолекулярный гепарин | Не согласие | Рекомендовано | Рекомендовано | Предпочтительнее нефракционированного гепарина |
| Нефракционированный гепарин | Не согласие | Рекомендовано | Не упоминается | |
| Синтетические протеазы | Не согласие | Рекомендовано | Не рекомендовано | Не упоминается |
| Рекомбинированный человеческий активированный протеин C (rhAPC) | Рекомендовано | Не согласие | Рекомендовано | Необходимость дальнейшего изучения в РКИ |
| Антитромбин | Не рекомендовано | Рекомендовано | Не рекомендовано | Необходимость дальнейшего изучения в РКИ |
| Рекомбинированный человеческий тромбомодулин (rhTM) | Не согласие | Не согласие | Не рекомендовано | Необходимость дальнейшего изучения в РКИ |
| Антифибринолитические средства | Рекомендовано | Не рекомендовано | Рекомендовано (рекомендации низкой степени доказательности) | |
| Плазмаферез | Не согласие | Не согласие | Не рекомендовано | Не упоминается |
Также была предложена следующая таблица для выбора лечения ДВС-синдрома в зависимости от его преобладающего типа:
| Лечение | Бессимптомный тип | Тип органной недостаточности | Кровоточащий тип | Массивный кровоточащий тип |
| Лечение основного заболевания | Рекомендовано | Рекомендовано | Рекомендовано | |
| Переливание крови | Рекомендовано | Рекомендовано | ||
| Гепарин | Рекомендовано | Не рекомендовано | Не рекомендовано | |
| Ингибиторы фактора Ха (фондапаринукс, ривароксабан, апиксабан) | Не рекомендовано | Не рекомендовано | ||
| Синтетические ингибиторы протеазы | Рекомендовано | Рекомендовано | ||
| Природные ингибиторы протеаз | Рекомендовано | Не рекомендовано | ||
| Антифибринолитическое лечение | Не рекомендовано | Не рекомендовано | Рекомендовано | Рекомендовано |
Переливание крови
Значительно низкий уровень тромбоцитов и факторов свертывания, особенно фибриногена, может увеличить риск кровотечения. Вышеупомянутые четыре руководства рекомендовали введение концентрата тромбоцитов и свежезамороженной плазмы (СЗП) пациентам с ДВС-синдромом с активным кровотечением или пациентам с высоким риском кровотечения, требующим инвазивных процедур, без доказательств высокого качества. Порог переливания концентрата тромбоцитов зависит от клинического состояния пациента с ДВС-синдромом. Как правило, переливание концентрата тромбоцитов назначают пациентам с ДВС-синдромом с активным кровотечением и числом тромбоцитов ≤50 × 109/л. Для пациентов без кровотечения, у которых к примеру, после химиотерапии, развивается ДВС-синдром, принят гораздо более низкий порог переливания концентрата тромбоцитов от 10 до 20 × 109/л. Переливание концентрата тромбоцитов можно назначать в более высоких дозах пациентам, у которых имеется высокий риск кровотечения на основании других клинических или лабораторных признаков. Переливание концентрата тромбоцитов или СЗП обычно выполняется пациентам с массивным кровотечением или кровотечением при ДВС-синдроме. Необходимо использовать большие объемы плазмы для коррекции дефектов свертывания, связанных с длительным АЧТВ или протромбиновым временем (более чем в 1,5 раза выше нормального значения) или сниженным уровнем фибриногена (менее 1,5 г/дл). Начальная доза СЗП 15 мл/кг рекомендуется и обычно назначается. Поскольку в этом контексте следует учитывать последствия объемной перегрузки, в этой ситуации могут быть полезны меньшие объемы концентрата протромбинового комплекса. Поскольку специфический дефицит фибриногена, связанный с ДВС-синдромом с массивным кровотечением, можно скорректировать с помощью введения очищенных концентратов фибриногена или криопреципитата, эти методы лечения рекомендуются в трех руководствах (см.таблица). Ответ на терапию компонентами крови следует контролировать как клинически, так и с помощью повторных оценок количества тромбоцитов и параметров свертывания после введения этих компонентов. Эффективность и безопасность рекомбинантного фактора VIIa у пациентов с ДВС-синдромом с опасными для жизни кровотечениями неизвестна, и это лечение следует использовать с осторожностью или в рамках клинических испытаний.
Гепарин
Гепарин может назначаться как для профилактики, так и для лечения пациентов с медленно развивающимся ДВС-синдромом, у которых развились тромбоэмболии или имеется риск их развития.
Хотя лечение антикоагулянтами является рациональным подходом, основанным на представлении о том, что ДВС-синдром характеризуется обширной активацией коагуляции, есть несколько различий в рекомендациях по применению гепарина у пациентов с ДВС-синдромом между четырьмя руководящими принципами (таблица).
Гепарин обычно не показан при быстро развивающемся ДВС-синдроме с сопутствующим кровотечением или риском его возникновения. Исключение составляет применение гепарина у женщин с мертвым плодом и в случае развивающегося у них ДВС-синдрома с выраженной тромбоцитопенией, снижением уровня фибриногена и факторов свертывания крови. Гепарин назначается таким пациенткам на несколько дней с целью контроля ДВС-синдрома, увеличения уровня фибриногена и количества тромбоцитов и снижения чрезмерного потребления факторов свертывания. Потом лечение гепарином прекращается и матку вычищают.
Терапевтические дозы гепарина следует рассматривать в случаях ДВС-синдрома, при котором преобладает тромбоз. Небольшое рандомизированное контролируемое исследование показало, что низкомолекулярный гепарин (НМГ) превосходит нефракционированный гепарин (НФГ) при лечении ДВС-синдрома, предполагая, что в этих случаях использование НМГ предпочтительнее, чем НФГ. Уровень ингибирования, достигаемый с помощью НМГ, выше для активированного фактора свертывания крови Ха (Ха), чем для тромбина. Пациенты с ДВС подвержены высокому риску развития ВТЭ, и профилактика ВТЭ с использованием НФГ, НМГ и / или механических методов стала стандартом лечения пациентов с ДВС-синдромом. Хотя экспериментальные исследования показали, что гепарин может, по крайней мере, частично ингибировать активацию коагуляции в условиях ДВС-синдрома, нет РКИ, демонстрирующих, что использование гепарина у пациентов с ДВС-синдромом приводит к улучшению клинически значимых результатов. Недавнее крупное исследование пациентов с тяжелым сепсисом показало незначительное преимущество низких доз гепарина в отношении 28-дневной смертности и подчеркнуло важность отказа от лечения гепарином у пациентов с ДВС-синдромом и аномальными параметрами коагуляции. Между тем, 28-дневная смертность ниже в группах плацебо, получавших гепарин, чем в группах плацебо без гепарина, согласно анализу подклассов РКИ при развитии тяжелого сепсиса. Назначение гепарина не рекомендуется пациентам с ДВС-синдромом с кровотечением или массивным кровотечением из-за повышенного риска кровотечения, хотя оно рекомендуется пациентам с бессимптомным типом ДВС-синдрома, чтобы предотвратить развитие тромбоза глубоких вен.
Ингибиторы фактора Ха (фондапаринукс, ривароксабан, апиксабан)
Имеются убедительные доказательства использования этих препаратов в качестве профилактики ТГВ, однако существует мало доказательств использования этих препаратов у пациентов с ДВС-синдромом, и они не рекомендуются пациентам с ДВС-синдромом с кровотечением или массивным кровотечением. Эти препараты также не рекомендуются пациентам с почечной недостаточностью.
Синтетические ингибиторы протеаз
Синтетические ингибиторы протеаз обладают множеством функций, включая антагонистические эффекты на систему кинин / калликреин, фибринолиз, систему комплемента и систему свертывания крови. Габексат мезилат® и нафамостат® часто использовались и оценивались в Японии, однако нет РКИ, показывающих снижение смертности или улучшение скорости разрешения ДВС-синдрома. Поскольку эти препараты обладают мягким антикоагулянтным и антифибринолитическим действием, они часто используются у пациентов с кровотечениями, массивными кровотечениями и бессимптомными типами ДВС-синдрома.
Природные ингибиторы протеаз
Использование агентов, способных восстанавливать дисфункциональные антикоагулянтные пути у пациентов с ДВС-синдромом, широко изучалось. Несмотря на то, что существует множество РКИ с участием клинически больных пациентов, почти все РКИ были проведены с участием пациентов с сепсисом, и несколько РКИ с участием пациентов с ДВС-синдромом предполагают, что BCSH и SISET определили свои рекомендации по лечению ДВС-синдрома на основе исследований сепсиса, а не ДВС-синдрома. Данные комплексы ингибируют Ха фактор и тромбин, FVa и FVIIIa факторы свёртывания. В каждом из четырех руководств представлены разные рекомендации относительно использования концентратов антикоагулянтного фактора. Крупномасштабное многоцентровое РКИ, непосредственно оценивающее влияние данных препаратов на смертность у пациентов с тяжелым сепсисом, не показало значительного снижения её у пациентов, получавших данные препараты.
В настоящее время диагностика и лечение ДВС-синдрома должны проводиться в соответствии с типом ДВС-синдрома на основе четырех опубликованных рекомендаций по ДВС-синдрому.
Прогноз
При ДВС-синдроме, независимо от причины, вызвавшей его, прогноз неблагоприятный: от 20 % до 50 % пациентов умирают. При ДВС-синдроме, осложненном сепсисом, имеются значительно более высокие уровни смертности. Прогноз при ДВС-синдроме варьирует в зависимости от основной патологии и степени внутрисосудистого тромбоза. Так на 1 и 2 стадии он благоприятный при проведении своевременного адекватного лечения, сомнительный на 3 стадии, летальный на 4 стадии.
Зарегистрируйтесь на нашем сайте прямо сейчас, чтобы иметь доступ к большему количеству обучающих материалов!
Подписаться на наши страницы:
Литература:
Levi M, Toh CH, Thachil J, Watson HG: Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol 2009, 145: 24-33. 10.1111/j.1365-2141.2009.07600.x
Wada H, Asakura H, Okamoto K, Iba T, Uchiyama T, Kawasugi K, Koga S, Mayumi T, Koike K, Gando S, Kushimoto S, Seki Y, Madoiwa S, Maruyama I, Yoshioka A, Japanese Society of Thrombosis Hemostasis/DIC subcommittee: Expert consensus for the treatment of disseminated intravascular coagulation in Japan. Thromb Res 2010, 125: 6-11. 10.1016/j.thromres.2009.08.017
Di Nisio M, Baudo F, Cosmi B, D’Angelo A, De Gasperi A, Malato A, Schiavoni M, Squizzato A, Italian Society for Thrombosis and Haemostasis: Diagnosis and treatment of disseminated intravascular coagulation: guidelines of the Italian society for haemostasis and thrombosis (SISET). Thromb Res 2012, 129: e177-e184. 10.1016/j.thromres.2011.08.028
Wada H, Thachil J, Di Nisio M, Mathew P, Kurosawa S, Gando S, Kim HK, Nielsen JD, Dempfle CE, Levi M, Toh CH, The Scientific Standardization Committee on DIC of the International Society on Thrombosis Haemostasis: Guidance for diagnosis and treatment of DIC from harmonization of the recommendations from three guidelines. J Thromb Haemost 2013, 11: 761-767. 10.1111/jth.12155
Данная статья носит ознакомительный характер. Самолечение может быть вредным для вашего здоровья. Применение любых препаратов, упомянутых в данной статье, возможно только по назначению и под наблюдением врача.
Смотрите также:
