Множественная миелома
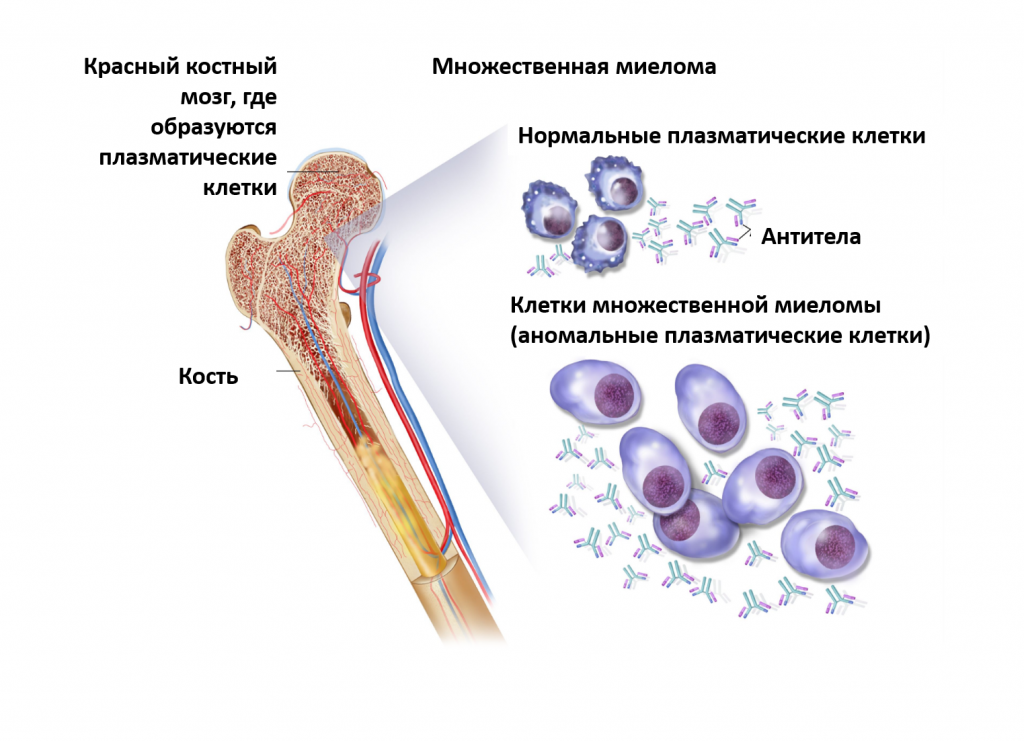
Множественная миелома (ММ) – это злокачественное новообразование из плазматических клеток, которые накапливаются в костном мозге, что приводит к разрушению костей и костномозговой недостаточности. Чаще ММ диагностируется у людей в возрасте от 65 до 74 лет, а медиана возраста составляет 69 лет.
Заболеваемость и эпидемиология
Множественная миелома (ММ) составляет 1% всех раковых заболеваний и 10% всех гематологических злокачественных новообразований. Заболеваемость в Европе составляет 4,5-6,0/100000/год со средним возрастом на момент установления диагноза 72 года. Смертность составляет 4,1/100000/год. Почти у всех пациентов ММ развивается из бессимптомного предракового заболевания, называемого моноклональной гаммапатией неопределенного значения (MGUS). MGUS прогрессирует в MM со скоростью 1% в год. У некоторых пациентов промежуточная бессимптомная, но более прогрессирующая предраковая стадия, называемая тлеющей (или вялой).
Клинические симптомы
Клинические симптомы возникают вследствие пролиферации опухолевых плазмоцитов и секреции моноклональных (патологических) белков и цитокинов:
- общие симптомы – слабость и потеря массы тела;
- оссалгия (самое частое проявление) – локализуется в поясничном отделе позвоночника, костях таза, ребрах, реже в черепе и трубчатых костях, обусловлена остеолитическими изменениями и патологическими переломами костей (напр., компрессионными переломами позвонков);
- неврологические симптомы вследствие компрессии или повреждения спинного мозга, спинномозговых корешков или черепных нервов патологическими переломами (напр. позвонков) или непосредственно опухолью: чаще всего радикулопатия, иногда парезы, параличи конечностей, недержание мочи или кала; сенсорная или сенсомоторная периферическая нейропатия, симметричная и дистальная, редко на момент диагностирования заболевания, чаще у больных с сопутствующим амилоидозом легких цепей иммуноглобулинов и при POEMS-синдроме, а также у больных, получающих нейротоксические ЛС (талидомид, бортезомиб);
- симптомы анемии (70%);
- проявления гиперкальциемии и ее последствий;
- повторные бактериальные инфекции дыхательной и мочевыделительной систем, а также вирусные инфекции (грипп, опоясывающий герпес);
- симптомы почечной недостаточности – у ≈30% больных на момент установления диагноза ММ; чаще всего это т.н. цилиндрическая нефропатия (тубуло-интерстициальный нефрит, вызванный интратубулярными цилиндрами, которые сформировались из легких цепей в моче);
- проявления синдрома повышенной вязкости крови (у <10% больных): чаще всего геморрагический диатез (кровотечения из носа и десен, пурпура), ухудшение остроты зрения, проявления со стороны ЦНС (головная боль, внезапная глухота, головокружение, атаксия, нистагм, расстройства сознания), обострение сердечной недостаточности;
- реже – экстрамедуллярные плазмоцитомы, симптомы сопутствующего AL-амилоидоза, гепатомегалия, увеличение периферических лимфоузлов и селезенки, сидром де Тони-Дебре-Фанкони.
Типичное течение
Приблизительно у 10–15 % больных легкое течение (бессимптомная миелома). В большинстве случаев заболевание прогрессирует или рецидивирует после последующих линий лечения.
Диагностика и патология/молекулярная биология
Диагностика ММ должна основываться на следующих тестах:
- Выявление и оценка моноклональной (М) составляющей путем электрофореза белков сыворотки и/или мочи (концентрат 24-часового сбора мочи); нефелометрическая количественная оценка IgG, иммуноглобулины IgA и IgM; характеристика тяжелых и световых цепей путем иммунофиксации; и измерение световой цепи без сыворотки (FLC).
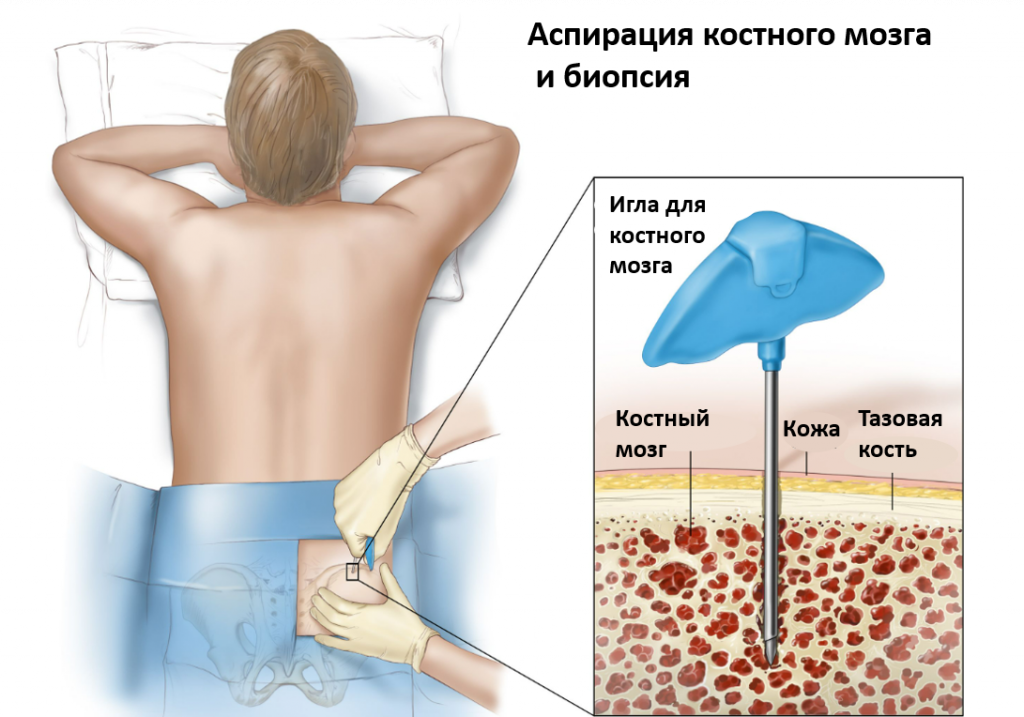
- Оценка инфильтрации плазматических клеток костного мозга: аспирация костного мозга и/или биопсия являются стандартными вариантами оценки количества и характеристик плазматических клеток в костном мозге. Кроме того, образец костного мозга следует использовать для исследований цитогенетической/флуоресцентной гибридизации in situ (FISH) на иммунологически распознанных или отсортированных плазматических клетках, и он также может быть использован для иммунофенотипических и молекулярных исследований.
- Оценка литических костных поражений: низкодозовая компьютерная томография (WBLD-CT) всего тела является новым стандартом для диагностики литической болезни. Обычная рентгенография также может использоваться, если WBLD-CT недоступен. Магнитная резонансная визуализация (МРТ) предоставляет более подробную информацию и рекомендуется при подозрении на компрессию спинного мозга.
- Чтобы отличить симптомную и бессимптомную ММ, необходимы следующие лабораторные исследования на исходном уровне: общий анализ крови (ОАК) с лейкоцитарной формулой и подсчетом тромбоцитов.
- Исследование мазка периферической крови.
- Азот мочевины крови (АМК).
- Креатинин в сыворотке крови.
- Клиренс креатинина (рассчитанный или измеренный непосредственно).
- Электролиты в сыворотке крови; печеночные пробы; кальций в сыворотке крови; альбумин; лактатдегидрогеназа (ЛДГ).
- Бета2 микроглобулин.
- Исследование мазка периферической крови может показать аномальное распределение эритроцитов, например образование «монетных столбиков» (т.е. склеивание эритроцитов подобно монетным столбикам) из-за повышенного уровня белков сыворотки.
- Повышение АМК и креатинина указывает на снижение функции почек, в то же время уровни ЛДГ и бета-2-микроглобулина отражают характеристики опухолевых клеток.
- Анализ сыворотки включает количественное определение уровня иммуноглобулинов (IgG, IgA и IgM); электрофорез белков сыворотки (serum protein electrophoresis, SPEP) для количественного определения моноклонального белка; электрофорез с иммунофиксацией сыворотки (serum immunofixation electrophoresis, SIFE) для получения более конкретной информации о типе присутствующего М-белка.
- Оценка изменений уровня разных белков, в частности М-белка, помогает отследить прогрессирование заболевания и ответ на лечение. Анализ мочи в пределах начальной диагностики включает оценку суточной мочи на общий белок, электрофорез белков мочи (UREP) и электрофорез с иммунофиксацией мочи (urine immunofixation electrophoresis, UIFE).
- Анализ на свободные легкие цепи: анализ сыворотки на свободные легкие цепи (free light-chain, FLC) вместе с анализами сыворотки (SPEP и SIFE) обеспечивает высокую чувствительность при скрининге на ММ и родственные плазмоклеточные заболевания. Он также помогает в прогнозировании моноклональной гаммапатии неопределенного генеза (МГНГ), «тлеющей» миеломы, активной ММ, амилоидоза легких цепей иммуноглобулинов и солитарной плазмоцитомы. Анализ сыворотки на FLC также позволяет проводить количественный мониторинг пациентов с амилоидозом легких цепей и миеломой легких цепей.
Кроме всего вышеперечисленного, соотношение свободных легких цепей (FLC ratio, FLCr) необходимо для документирования строгого полного ответа (СПО) в соответствии с Едиными критериями ответа Международной рабочей группы по миеломе (International Myeloma Working Group, IMWG).
После количественного определения М-белка важно использовать тот же анализ для серийных исследований, чтобы обеспечить точное относительное количественное определение.
Оценка костного мозга
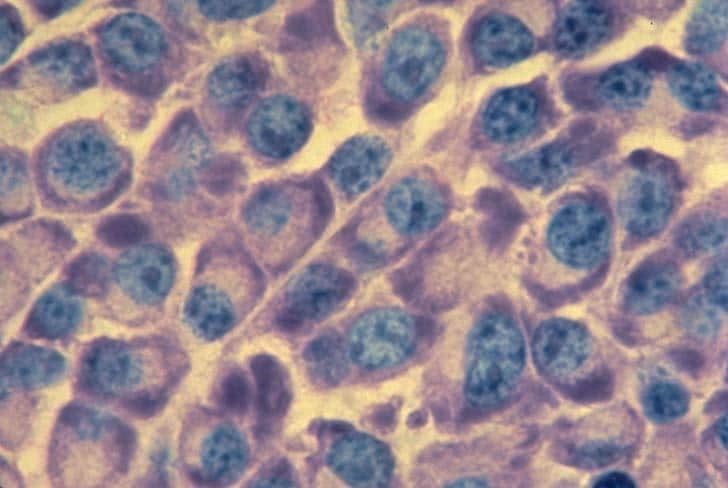
Для диагностики ММ основным критерием является процент клональных плазматических клеток костного мозга (≥10%). Процент плазматических клеток в костном мозге оценивается путём односторонней аспирации и биопсии костного мозга. Для подтверждения наличия моноклональных плазматических клеток и более точной количественной оценки поражения плазматических клеток могут быть использованы иммуногистохимический анализ и/или проточная цитометрия. Цитоплазма аномальных плазматических клеток содержит легкие цепи каппа или лямбда, и преобладание плазматических клеток, экспрессирующих ту или иную легкую цепь, указывает на клональность. Конкретные иммунофенотипические профили клеток миеломы могут иметь прогностическое значение.
Плазмоциты в мазке костного мозга
Существует несколько видов плазмоцитарных новообразований. Все эти заболевания связаны с моноклональным (или миеломным) белком (М-белком). Они включают моноклональную гаммапатию неопределенного значения (MGUS), изолированную плазмоцитому кости, экстрамедуллярную плазмоцитому и множественную миелому.
Важно отличать ММ от других плазмоклеточных новообразований/гематологических заболеваний, чтобы правильно определить прогноз и назначить соответствующее лечение.
| Плазматическая неоплазма | Тип протеина M | Патология | Клиническая картина |
| Ig = иммуноглобулин; MGUS = моноклональная гаммпатия неопределенного значения | |||
| MGUS | IgG каппа или лямбда; или IgA каппа или лямбда | <10% плазматических клеток в костном мозге | Бессимптомный, с минимальными признаками заболевания (кроме наличия белка М) |
| Изолированная плазмоцитома кости | IgG каппа или лямбда; или IgA каппа или гамма | Солитарное поражение костей; <10% плазматических клеток в костном мозге непораженного участка | Бессимптомный или симптоматический |
| Экстрамедуллярная плазмоцитома | IgG каппа или лямбда; или IgA каппа или гамма | Солитарное поражение мягких тканей; чаще всего возникает в носоглотке, миндалинах или околоносовых пазухах | Бессимптомный или симптоматический |
| Множественная миелома | IgG каппа или лямбда; или IgA каппа или гамма | Нередко множественные поражения костей | Симптоматический |
Моноклональная гаммапатия неопределенного значения (MGUS)
Пациенты с MGUS имеют белок М в сыворотке крови без признаков множественной миеломы, макроглобулинемии, амилоидоза или лимфомы и имеют менее 10% плазматических клеток в костном мозге.
Эти типы пациентов протекают бессимптомно и не нуждаются в лечении. Пациенты с MGUS и факторами риска прогрессирования заболевания, однако, должны находиться под тщательным наблюдением, поскольку они имеют большую вероятность развития миеломы (чаще всего), амилоидоза, лимфоплазмоцитарной лимфомы или хронической лимфолейкемии, и тогда может потребоваться терапия.
Практически всем случаям множественной миеломы предшествует постепенное повышение уровня MGUS. Годовой риск прогрессирования MGUS к лимфоидной или плазматической злокачественной опухоли колеблется от 0,5 до 1,0% в популяционных когортах.
Факторы риска, предполагающие прогрессирование заболевания, включают следующее:
- Аномальное соотношение сыворотка-FLC;
- MGUS класса не IgG;
- Высокий уровень сывороточного белка М (≥1,5 г/дл).
Моноклональные гаммопатии, вызывающие повреждение органов, в частности почек, сердца или периферических нервов, требуют немедленной терапии с использованием тех же стратегий, которые применяются для обычных плазмоцитарных дискразий. Моноклональная гаммопатия, вызывающая дисфункцию почек — через прямое отложение антител или амилоидоз — называется моноклональной гаммопатией почечного значения. Повышение уровня креатинина в сыворотке крови, снижение скорости клубочковой фильтрации и увеличение экскреции альбумина с мочой – это все параметры, которые могут указывать на повреждение почек и оцениваются проспективно для пациентов с MGUS высокого риска. Хотя N-концевой промозговой натрийуретический пептид является очень чувствительным маркером привлечения амилоида в сердце, следует отметить низкую специфичность. Эти дополнительные тесты включены вместе с уровнем М-белка, уровнями FLC и соотношением FLC при наблюдении за пациентами с MGUS.
Изолированная плазмоцитома кости
У пациента изолирована плазмоцитома кости, если обнаружено:
- Солитарное литическое поражение плазматических клеток при осмотре скелета у бессимптомного пациента.
- Исследование костного мозга из непораженного участка содержит менее 10% плазматических клеток.
- МРТ может выявить непредсказуемые поражения костей, не обнаруженных на стандартных рентгенограммах. МРТ всего позвоночника и таза может выявить другие костные поражения.
Экстрамедуллярная плазмоцитома
У пациента экстрамедуллярная плазмоцитома, если обнаружено:
- Изолированные плазматические опухоли мягких тканей, чаще всего возникающие в миндалинах, носоглотке или околоносовых пазухах.
- Отрицательные результаты рентгеновских снимков скелета и биопсии костного мозга.
Множественная миелома
Множественная миелома — системная злокачественная опухоль плазматических клеток, которая обычно поражает несколько участков в костном мозге и секретирует полностью или частично моноклональное антитело.
Клинические результаты
На основании результатов клинического и лабораторного обследования пациенты сначала классифицируются как имеющие моноклональную гаммапатию неопределенного генеза (МГНГ), солитарную плазмоцитому, «тлеющее» (бессимптомное) заболевание или активное (симптомное) заболевание. В последнее время пациентов с МГНГ, имеющих системные эффекты, связанные с моноклональной гамапатией, классифицируют как имеющих клинически значимую моноклональную гаммапатию или моноклональную гаммапатию почечного генеза в зависимости от характера поражения органов.
Критерии CRAB
Критерии CRAB, позволяющие определить ММ, включают:
- С (calcium levels) – повышенный уровень кальция (более 11,5 мг/дл)
- R (renal insufficiency) — почечная недостаточность (креатинин более 2 мг/дл или клиренс креатинина менее 40 мл/мин)
- A (anemia) — анемию (гемоглобин менее 10 г/дл) на 2 г/дл меньше нормы
- B (bone lesions) – наличие поражений костей
IMWG также уточнила, что наличие одного или нескольких остеолитических очагов поражения, обнаруженных во время рентгенографии скелета, МРТ всего тела или ПЭТ/КТ всего тела с ФДГ соответствует критериям поражения костей.
Биомаркеры, определяющие ММ, определенные критериями IMWG SLiM (SLiM расшифровывается как Sixty – шестьдесят, Light chain ratio – соотношение легких цепей, MRI – МРТ), включают одно или несколько из следующего:
- шестьдесят или более процентов клональных плазматических клеток в костном мозге;
- соотношение вовлеченных/невовлеченных FLC равно 100 или более, в то же время уровень пораженных свободных легких цепей равен или превышает 100 мг/л;
- или МРТ с более чем одним очаговым поражением костного мозга (не остеолитическим).
Все эти явления, определяющие миелому, называются SLiM-CRAB.
Критерии IMWG для пациентов с «тлеющей» (бессимптомной) миеломой включают сывороточный М-белок (IgG или IgA) ≥ 30 г/л и/или клональные плазматические клетки костного мозга от 10 до 59% и отсутствие признаков CRAB, явлений, определяющих миелому, или амилоидозу. Обновленные диагностические критерии ММ IMWG позволяют начать терапию до начала поражения органов-мишеней на основе специфических биомаркеров, а также использовать чувствительные критерии визуализации для диагностики ММ, включая ПЭТ/КТ всего тела с ФДГ и МРТ.
Пациентов с активной ММ можно классифицировать с помощью Международной системы стадирования (International Staging System, ISS). ISS основывается на легко получаемых лабораторных показателях (сывороточный бета-2-микроглобулин и сывороточный альбумин) и более проста в использовании, чем система стадирования Дюри-Сальмона, для пациентов с ранее не леченной ММ.
Международная система стадирования (ISS) для множественной миеломы
| Стадия | Критерии | Средняя выживаемость (мес.) |
| I-FISH = интерфазная флуоресцентная гибридизация in situ; ЛДГ = лактатдегидрогеназа; R-ISS = пересмотренная интернациональная система стадирования | ||
| І | Бета-2-микроглобулин <3,5 мг/л и альбумин ≥3,5 г/дл | Не достигнута |
| II | Не R-ISS I или III | 83 |
| III | Бета-2-микроглобулин ≥5,5 мг/л и высокий уровень LDH или хромосомные аномалии высокого риска по I-FISH (определяются как наличие del(17p) и/или транслокации t(4;14) и/или транслокации t(14) ) ;16)) | 43 |
Система ISS была пересмотрена (R-ISS) и теперь охватывает бета-2-микроглобулин и альбумин сыворотки крови, а также прогностическую информацию, полученную на основе уровня ЛДГ и хромосомных аномалий высокого риска (t(4;14), t(14;16), делеция 17p13), обнаруженных с помощью FISH, и является предпочтительным методом стадирования.
Пациенты с del(17p) и/или транслокацией t(4;14) и/или транслокацией t(14;16) относятся к группе высокого риска. Пациенты без хромосомных аномалий высокого риска относятся к группе стандартного риска.
Генетические факторы и группы риска
Более новейшие клинические исследования распределяют пациентов с множественной миеломой на так называемые группы стандартного риска, среднего риска и высокого риска на основе генетических аберраций, выявленных с помощью I-FISH. Стратификация, основанная на цитогенетических результатах, была получена в результате ретроспективного анализа и нуждается в проспективной проверке. Образцы костного мозга посылаются на цитогенетический анализ и анализ FISH. Плазмоклеточная лейкемия имеет особенно плохой прогноз. В противном случае благоприятный прогноз гиперплоидии превосходит сопутствующую неблагоприятную цитогенетику.
Группы риска множественной миеломы
| Группа риска | Цитогенетические данные) | Характеристика заболевания | Медиана выживания (лет) |
| FISH = флуоресцентная гибридизация in situ; Ig=иммуноглобулин | |||
| Стандартный риск | Имеет любые из нижеприведенных цитогенетических находок: отсутствие неблагоприятных FISH или цитогенетики, гипердиплоидия, t(11;14) по FISH или (4) t(6;14) по FISH | Эти пациенты чаще всего имеют заболевания, экспрессирующие IgG каппа моноклональные гаммопатии и литические поражения костей | 8–10 |
| Промежуточный риск | t(4;14) с помощью FISH | Эти пациенты часто имеют IgA-лямбда-моноклональные гаммопатии и реже заболевания костей | 5 |
| Высокий риск | Имеет любые из следующих цитогенетических находок: del 17p по FISH, t(14;16) по FISH, t(4;14), t(14;20), цитогенетический del 13, негипердиплоидия без неблагоприятных цитогенетических находок, увеличение 1q или лейкоз плазмоцитов | Эти пациенты имеют заболевания, экспрессирующие IgA лямбда моноклональные гаммопатии (часто) и осложнения, связанные со скелетом (реже) | 2 |
Хотя ММ может быть морфологически схожей, на генетическом и молекулярном уровнях было обнаружено несколько подтипов заболевания. Исследования костного мозга во время начальной диагностики должны включать анализ хромосом методом гибридизации флуоресцентной in situ (fluorescence in situ hybridization, FISH), проведенный на плазматических клетках, полученных во время аспирации костного мозга. Дополнительную информацию можно получить с помощью цитогенетического метафазного исследования.
У пациентов с ММ были обнаружены специфические хромосомные аномалии, включающие транслокацию, делецию или амплификацию. Делеция 17p13 (локус для гена-супрессора опухоли, p53) приводит к потере гетерозиготности гена TP53 и считается признаком высокого риска развития ММ10-12. Этот риск достоверно повышается при условии более высокой доли клеток миеломы с этой аномалией, а также оставшейся мутации аллеля.
Другие хромосомные аберрации высокого риска по ММ характеризуются структурными изменениями, включающими специфические перестройки с участием гена IGH (кодирующего тяжелую цепь иммуноглобулина), расположенного в позиции 14q32. На основании транслокаций 14q32 выделяют несколько подгрупп пациентов. Основными транслокациями являются t(11;14)(q13;q32), t(4;14)(p16;q32), t(14;16)(q32;q23) и t(14;20)(q32;q12).
Несколько исследований подтвердили, что пациенты с ММ с транслокациями t(4;14), t(14;16) и t(14;20) имеют плохой прогноз, в то же время t(11;14), как считается, привносит меньший риск.
Делеция Del(13q) — распространенная аномалия, которая наблюдается при исследованиях методом FISH, но является отрицательным прогностическим фактором только если наблюдается во время метафазного цитогенетического исследования.
К частым хромосомным изменениям ММ также относятся аномалии хромосомы 117. В коротком плече хромосомы чаще всего возникают делеции, в длинном — амплификации. Усиление/амплификация 1q21, а также делеция 1p повышают риск прогрессирования ММ, а частота амплификации выше у пациентов с рецидивами, чем у пациентов с впервые диагностированным заболеванием.
Стратификация пациентов на различные группы риска в зависимости от хромосомных маркеров используется некоторыми центрами при консультировании по прогнозу заболевания, отбору пациентов и определению последовательности применения терапевтических подходов. Целью применения панели FISH для прогностической оценки плазматических клеток должно быть выявление наличия del 13, del 17p13, t(4;14), t(11;14), t(14;16), t(14:20), усиления/амплификации 1q21 и делеции 1p. Полезность этой информации заключается в определении биологического подтипа, предоставлении прогностических рекомендаций, а также в определении кандидатов для участия в клинических исследованиях.
Визуализация
В течение десятилетий обзорное рентгенологическое исследование скелета являлось стандартом для оценки впечатления костей у любого человека с подозрением на ММ. Однако этот метод имеет существенные ограничения, связанные с более низкой чувствительностью по сравнению с современными методами визуализации.
Было показано, что компьютерная томография (КТ) в отдельности или в сочетании с позитронно-эмиссионной томографией (ПЭТ) с фтордезоксиглюкозой (ФДГ) по чувствительности выявления остеолитических поражений достоверно преобладает указанный выше метод у пациентов с моноклональными плазмоклеточными заболеваниями. В многоцентровом анализе, выполненном IMWG, традиционное обзорное рентгенологическое исследование скелета сравнивали с КТ всего тела у 212 пациентов с моноклональными плазмоклеточными заболеваниями.
Результаты КТ всего тела были положительными у 25,5% пациентов с отрицательными результатами обзорного рентгенологического исследования скелета. Чувствительность обзорного рентгенологического исследования скелета и низкодозовой КТ всего тела для длинных костей не отличается, разница преимущественно заключается в выявлении аномалий в позвоночнике и тазу.
Кроме того, исследования показали, что КТ всего тела с низкой дозой облучения превышает эффективность обзорной рентгенографии скелета в участках, которые трудно визуализировать во время обзорного рентгенологического обследования скелета, таких как кости черепа и ребра. Также было показано, что ПЭТ/КТ с ФДГ выявляет большее поражение, чем обычная рентгенография, и выявляет поражение у пациентов с отрицательными результатами обзорного рентгенологического исследования скелета.
Следует отметить, если вместо низкодозовой КТ всего тела выбирается ПЭТ/КТ, качество визуализации КТ-компонента ПЭТ/КТ должно быть эквивалентно низкодозовой КТ всего тела. Обычно КТ компонент используется только для коррекции ослабления, что может оказаться недостаточным для оценки поражения костей вследствие ММ и стабильности позвоночника. ПЭТ/КТ всего тела полезна для выявления экстрамедуллярного поражения вне позвоночника.
Для начальной диагностики пациентов с подозрением на ММ рекомендуется либо низкодозовая КТ всего тела, либо ПЭТ/КТ с ФДГ.
Отмечено, что обзорное рентгенологическое исследование скелета, включая длинные кости, приемлемо в случаях, когда визуализационное исследование с применением современных методов недоступно (например, в условиях ограниченных ресурсов). КТ с контрастными веществами не является необходимой для выявления миеломного поражения костей и, по возможности, ее следует избегать у пациентов с миеломой.
МРТ полезна для дифференциации «тлеющей» миеломы от ММ. Поскольку тяжесть заболевания у пациентов с тлеющей миеломой ниже, чем у пациентов с ММ, необходимо использовать методы визуализации с высокой чувствительностью, а МРТ является чувствительным методом выявления инфильтрации костного мозга миеломой.
Если результаты низкодозовой КТ всего тела или ПЭТ/КТ с ФДГ отрицательные, следует рассмотреть возможность проведения МРТ всего тела без контрастирования, чтобы отличить тлеющую миелому от ММ.
Для подтверждения наличия плазмоцитомы может также потребоваться биопсия тканей. Анализ пролиферации плазматических клеток может быть полезен для определения пролиферирующих популяций клеток миеломы. Кроме того, при подозрении на амилоидоз диагноз устанавливается в соответствии с рекомендациями, изложенными в NCCN Guidelines относительно системного амилоидоза легких цепей. При подозрении на клинические симптомы повышенной вязкости следует оценивать вязкость сыворотки, особенно у пациентов с высоким уровнем М-белка. Если пациент рассматривается как кандидат на аллогенную трансплантацию, то необходимо определить его статус по системе лейкоцитарных антигенов человека (HLA-системе). Матричный анализ однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) и/или секвенирование нового поколения (next generation sequencing, NGS) на соответствующих панелях для материала костного мозга помогают провести более подробную оценку генетики ММ, что позволяет дополнительно классифицировать риск путем выявления дополнительных аномалий, которые могут иметь прогностическое и/или терапевтическое значение.
Также рекомендуется идентификация исходного клона или хранение образца аспирата костного мозга для идентификации клонов для предстоящего тестирования минимальной остаточной болезни (minimal residual disease, MRD) методом NGS, если это необходимо, а также оценка плазматических клеток, циркулирующих в периферической крови, по клиническим показаниям.
Основной проблемой при лечении плазматических новообразований является отделение стабильной бессимптомной группы пациентов, не нуждающихся в немедленном лечении, от пациентов с прогрессирующей симптоматической миеломой, которых, возможно, следует лечить немедленно. Моноклональную гаммапатию неопределенного значения или тлеющую миелому следует отличать от прогрессирующей миеломы.
Бессимптомные плазмоцитиновые новообразования (тлеющая множественная миелома)
Бессимптомные пациенты с множественной миеломой, не имеющие литических поражений костей и с нормальной функцией почек, могут сначала безопасно наблюдаться вне контекста клинических испытаний. Нарастающая анемия является наиболее надежным показателем прогрессирования.
Следующие критерии представляют новое определение тлеющей миеломы.
- Сывороточный моноклональный белковый иммуноглобулин (Ig) G или IgA не менее 30 г/л или моноклональный белок мочи не менее 500 мг в 24 часа.
- Клональные плазматические клетки костного мозга от 10% до 60% (60% означает явную миелому).
- Отсутствие амилоидоза или миеломных явлений, таких как:
- Гиперкальциемия более чем на 1 мг/дл выше нормы.
- Креатинин более 2 мг/дл или клиренс креатинина менее 40 мл/мин.
- Анемия с гемоглобином менее 10 г/дл.
- Поражение костей (одно или более) на рентгенографии скелета, компьютерной томографии (КТ) или позитронно-эмиссионной томографии (ПЭТ)-КТ.
- Процент клональных плазматических клеток в костном мозге составляет 60% или больше.
- Соотношение вовлеченный: непривлеченная легкая цепь без сыворотки (FLC) составляет 100 или более.
- Более одного очага поражения по крайней мере 5 мм на магнитно-резонансной томографии (МРТ) позвоночника.
Симптоматические плазматические новообразования
Пациенты с симптоматическим запущенным заболеванием нуждаются в лечении.
Лечение чаще всего направлено на уменьшение нагрузки на опухолевые клетки и устранение каких-либо осложнений заболевания, таких как почечная недостаточность, инфекция, повышенная вязкость или гиперкальциемия с помощью соответствующего медицинского лечения. Международная рабочая группа по миеломе (IMWG) опубликовала новые критерии для идентификации пациентов с активной миеломой, нуждающихся в терапии. Эти критерии включают следующее:
- Амилоидоз.
- Гиперкальциемия более чем на 1 мг/дл выше нормы.
- Креатинин более 2 мг/дл или клиренс креатинина менее 40 мл/мин. Миелома может вызвать нарушение функции почек из-за гиперкальциемии, амилоидоза или болезни отложения легких цепей.
- Анемия с гемоглобином менее 10 г/дл.
- Поражение костей (одно или большее) на рентгенографии скелета, МРТ всего тела или МРТ позвоночника и таза или ПЭТ-КТ.
- Процент клональных плазматических клеток в костном мозге составляет 60% или больше.
- Привлекаемый коэффициент FLC непривлеченной сыворотки 100 или более.
- Более одного очагового поражения размером по крайней мере 5 мм при осмотре костей скелета или, если результат отрицательный, МРТ всего тела, или МРТ позвоночника и таза, или ПЭТ-КТ.
Прогноз
Множественная миелома хорошо поддается лечению, но редко излечима. Средняя выживаемость в эпоху прехимиотерапии составляла около 7 месяцев. После введения химиотерапии прогноз значительно улучшился: медиана выживаемости составила от 24 до 30 месяцев, а 10-летняя выживаемость составила 3%.
Улучшение прогноза произошло благодаря внедрению новых биологических методов лечения и лучших вариантов спасения, медиана выживаемости в настоящее время превышает 60–90 месяцев.
Множественная миелома потенциально излечима, если она проявляется как одиночная плазмоцитома кости или как экстрамедуллярная плазмоцитома.
Не существует общепринятой системы определения стадии для моноклональной гаммпатии неопределенного значения, изолированной плазмоцитомы кости или экстрамедуллярной плазмоцитомы. Из плазматических новообразований система стадирования существует только для множественной миеломы.
Лечение
Современную терапию пациентов с симптоматической миеломой можно разделить на следующие категории:
- Индукционная терапия.
- Консолидационная терапия, менее применимая для очень пожилых людей.
- Поддерживающая терапия.
Поддерживающая терапия, например бисфосфонаты.
Активная (симптомная) множественная миелома Впервые диагностированная ММ обычно чувствительна к разным классам препаратов: иммуномодуляторов (ИМ), ингибиторам протеасом (ИП) и моноклональным антителам.
Первичная терапия активной (симптомной) множественной миеломы
Пациенты с активной (симптомной) миеломой сначала получают первичную терапию, после чего применяется высокодозовая химиотерапия с аутологической трансплантацией гемопоэтических клеток (ТГК) у пациентов, отвечающих критериям трансплантации. Токсины стволовых клеток, таких как нитрозомочевина, или алкилирующие средства ставят под угрозу резерв стволовых клеток. Схем лечения с этими препаратами (в частности, мелфаланом) следует избегать у пациентов, являющихся потенциальными кандидатами на ТГК, пока у них не будут собраны стволовые клетки.
Одним из первых шагов в оценке пациентов с впервые диагностированной ММ является определение того, являются ли они кандидатами на получение высокодозовой терапии и трансплантации в зависимости от возраста и сопутствующих заболеваний. Однако следует отметить, что возраст и нарушение функции почек не являются абсолютными противопоказаниями к трансплантации. Поэтому важно направить пациента в центр ТГК для оценки того, соответствует ли он критериям проведения ТГК.
Пациенты в возрасте до 65 лет обычно считаются более молодыми и здоровыми, тогда как пациенты старше 75 лет обычно не подлежат трансплантации. Сопутствующие заболевания и трудоспособность являются важными определяющими факторами в любом возрасте, особенно в возрасте от 65 до 75 лет, которые помогают принять решение о праве на трансплантацию. Существуют номограммы для пожилых пациентов, чтобы определить ожидаемую продолжительность жизни, независимо от диагноза миеломы. Возраст, дисфункция органов и риск сердечно-сосудистых и тромботических осложнений влияют на выбор индукционной терапии и на рассмотрение консолидационной терапии, такой как консолидация аутологической трансплантации стволовых клеток (SCT). Большинство пациентов также получают лекарства с бисфосфонатами или ингибиторами RANKL для предотвращения осложнений, связанных со скелетом.
Для пациентов < 70 лет в хорошем клиническом состоянии, индукция с последующим проведением терапия высокими дозами АСТ является стандартным методом лечения.
Приоритетные схемы первичной терапии для недавно выявленных кандидатов на трансплантацию включают бортезомиб/леналидомид/дексаметазон и бортезомиб/циклофосфамид/дексаметазон.
Другие рекомендованные схемы первичной терапии для недавно выявленных кандидатов на трансплантацию Карфилзомиб/леналидомид/дексаметазон. Карфилзомиб – это ингибитор протеасом (ИП) второго поколения, который высокоселективно и необратимо связывается с протеасомой. Он вводится внутривенно.
Через 2–4 месяца терапии пациентам, отвечающим на терапию, обычно проводят аутологическую консолидацию SCT. После выздоровления после аутологической SCT проводят поддерживающую терапию к моменту рецидива. При рецидиве последующие терапии проводят последовательно, используя ранее успешные препараты (если интервал времени с момента предварительного воздействия составляет >1 года) или более новые препараты, которые раньше не пробовали.
Пациенты, не являющиеся кандидатами на трансплантацию, получают индукционную химиотерапию с триплетом (как описано для младшего здорового пациента) плюс моноклональное антитело к CD38, даратумумаб, или дублет и даратумумаб, которые могут лучше переноситься. Терапия продолжается до достижения максимального ответа, а затем применяется поддерживающая терапия рецидива. При рецидиве последующие терапии применяются последовательно (как описано для более молодого здорового пациента).
Критерии оценки ответа на лечение IMWG
| Критерии ответа на терапию | Критерии |
| Подтвержден полный ответ | Нормальное соотношение свободных легких цепей и отсутствие патологического клона клеток в костном мозге по данным иммуногистохимического и иммунофлюоресцентного исследований |
| Полный ответ | Негативная иммунофиксация в сыворотке и моче, отсутствие всех мягкотканных плазмоцитом; плазматические клетки в костном мозге ≤5% |
| Очень хороший частичный ответ | М-градиент в моче и сыворотке крови определяется только методом иммунофиксации или снижения М-градиента в сыворотке крови на ≥90% и М-градиент в моче <100 мг/сут. |
| Частичный ответ | Снижение М-градиента в сыворотке крови на ≥50% и снижение М-градиента в суточной моче на ≥90% или <200 мг/сут. Если М-градиент в сыворотке крови и моче не определяется, критерием оценки может быть уменьшение разности уровней патологических и нормальных легких цепей на ≥50%. Если свободные легкие цепи в сыворотке крови определить также невозможно, критерием является уменьшение плазматических клеток на ≥50% при условии, что исходное содержание плазматических клеток в костном мозге ≥30%. При наличии мягкотканной плазмацитомы – уменьшение ее размеров ≥50% |
| Стабилизация заболевания | Не отвечает критериям полного ответа, очень хорошего частичного ответа, частичного ответа или прогрессирования заболевания |
Прямые признаки обострения заболевания и/или нарушения в органах-мишенях:
а) появление новых плазмоцитов мягких тканей или новых костных поражений;
б) доказанное увеличение в размерах существующих плазмоцитов или костных поражений;
в) доказанное увеличение означает 50% (как минимум 1,0 см) увеличение периодически измеряемого диаметра очага поражения;
г) гиперкальциемия (>11,5 мг/100 мл) (2,65 ммоль/л);
д) снижение уровня гемоглобина ≥2 мг/100 мл.
Рецидив после ПВ (используется только, если конечной целью исследования является определение выживаемости) – любой один или несколько нижеследующих критериев: появление М-протеина в сыворотке крови и мочи при исследовании методом иммунофиксации или электрофореза; увеличение ≥5% плазматических клеток в костном мозге; появление каких-либо других признаков прогрессии заболевания (это может быть новая плазмоцитома, литические поражения кости или гиперкальциемия).
Поддерживающая терапия
Пациенты с миеломой, отвечающие на лечение, демонстрируют прогрессирующее падение белка М до достижения плато; дальнейшее лечение обычными дозами не приводит к дальнейшему улучшению. Это заставило исследователей подвергнуть сомнению, как долго следует продолжать лечение. Ни одно клиническое испытание не сравнивало напрямую консолидационный подход с поддерживающим подходом, чтобы оценить, какой является лучшим для продления ремиссии и, наконец, выживания. В большинстве клинических испытаний используется один или оба. Поддерживающие испытания с глюкокортикостероидами и интерфероном показали очень незначительное улучшение продолжительности ремиссии и выживания, но с токсичностью, которая преобладала. Эффективность и переносимость талидомида, леналидомида, бортезомиба и иксазомиба в условиях индукции и рецидива сделала эти препараты привлекательными вариантами в поддерживающих исследованиях.
Все испытания и мета-анализ поддерживающей терапии леналидомидом показали значительное улучшение ВБП, тогда как общая выживаемость улучшилась в одном исследовании и одном мета-анализе, оба после аутологической ТСК. Все эти исследования показали увеличение миелодисплазии или острого лейкоза с 3% до 7% для леналидомида, что соответствует другим исследованиям леналидомида. Этот повышенный риск в большинстве случаев наблюдается у пациентов, ранее применявших алкилирующие агенты. Дозы от 5 до 15 мг в день применялись постоянно или с 1 недельным перерывом ежемесячно. Для пациентов, которые не могут получать поддерживающую терапию леналидомидом, разумной альтернативой является иксазомиб.
После аутологической ВСК пациентам предлагают поддерживающую терапию леналидомидом на основе постоянной ВБП и случайных преимуществ ОС, описанных ранее. Но краткосрочная и долгосрочная токсичность, а также финансовая токсичность могут помешать реализации. Пациенты с высоким риском, особенно с del(17p) или t(14;16), могут нуждаться в поддержке бортезомибом (с или без леналидомида), но этот подход не основывается на доказательствах, и необходимы подтверждающие клинические исследования.
Лечение и профилактика миеломной болезни костей
Миеломная болезнь костей является следствием повышенной активности остеокластов, и ингибирующие остеокласты агенты являются важным компонентом терапии миеломы. Бисфосфонаты памидронат и золедронат используются чаще всего путем внутривенной инфузии, но вводимый подкожно ингибитор моноклональных антител RANKL деносумаб также эффективен, особенно когда дисфункция почек не позволяет использовать бисфосфонаты.
Бисфосфонаты обычно вводят внутривенно ежемесячно в течение 2 лет, а затем продолжают по тому же или по сокращенному графику (т.е. один раз каждые 3–4 месяца), если есть доказательства активной миеломной болезни костей.
Деносумаб значительно дороже бисфосфонатов, которые доступны в общей форме.
В отличие от бисфосфонатов, оборотный механизм действия деносумаба может привести к повторным переломам, если его прекратить, хотя это теоретическое беспокойство относительно пациентов с миеломой может быть смягчено непрерывной поддерживающей терапией.
Рекомбинантные человеческий эритропоэтин и дарбепоэтин альфа могут использоваться для лечения миелом-ассоциированной анемии (уровень гемоглобина <10 г/дл), когда другие причины анемии были исключены. Целью является поддержание гемоглобина около 12 г/dl (ниже 14 г/дл во избежание тромбоэмболических осложнений и гипертонической болезни).
Лечение гранулоцитарным колониестимулирующим фактором (G-CSF) может потребоваться для лечения тяжелой гранулоцитопении, вызванной химиотерапией. Инфекционные эпизоды требуют немедленной терапии антибиотиками широкого спектра действия. Профилактика инфекции остается противоречивой, но может оказаться полезной в течение первых 2-3 месяцев после начала терапии, особенно у пациентов, получающих леналидомид или помалидомид или у пациентов с высоким риском инфицирования (предварительно серьезные инфекции или нейтропения). Рекомендуются прививки от гриппа и пневмококка.
Ацикловир или валацикловир для профилактики вируса герпеса рекомендован для пациентов, получающих терапию на основе ингибиторов протеасом. Иммуноглобулинная профилактика рутинно не рекомендуется.
Венозная тромбоэмболия. У пациентов с ММ наблюдается повышенный риск тромбоза с начальным риском 3-4% венозных тромботических событий, и этот риск значительно повышается в условиях терапии с применением специфических препаратов. Высокие дозы дексаметазона, цитотоксическая химиотерапия, такая как доксорубицин и IMiDs (талидомид и lenalidomide), существенно повышают этот риск. Другие факторы, такие как снижение подвижности вследствие неврологических осложнений или болей в костях, сопутствующие переломы, одновременное применение эритропоэз стимулирующих агентов и предыдущий личный или семейный анамнез тромботических событий повышают риск тромбоэмболических событий. Текущие рекомендации для пациентов с ММ, которые должны начать IMiD-терапию, заключаются в том, чтобы применять аспирин (100 мг) при отсутствии факторов риска тромбоза и применять полные дозы антикоагулянтов для лиц с повышенным риском (низкомолекулярные гепарины или варфарин).
Лучевая терапия при поражениях костей
ММ – высокорадиочувствительная опухоль, однако лучевую терапию как самостоятельный метод используют очень редко. Используемые дозы колеблются в широких пределах — 35–50 Гр за 4–5 нед. В большинстве случаев лучевую терапию назначают на зоны возможных патологических переломов в дозе от 15–30 Гр как метод профилактики их возникновения или на зоны существующих переломов для их консолидации.
Локальная лучевая терапия также эффективна для уменьшения выраженности болей в костях. Согласно результатам исследований при применении лучевой терапии уменьшение выраженности боли отмечалось у 91–97% пациентов, в том числе полное исчезновение болевого синдрома – у 21–26% пациентов, получивших фракционированную лучевую терапию.
Литические поражения позвоночника обычно требуют облучения, если есть любой из следующих фактов:
- Они связаны с экстрамедуллярной (параспинальной) плазмоцитомой.
- Возникла болезненная деструкция тела позвонка.
- КТ или МРТ показывают сжатие спинного мозга.
Боль в спине, вызванная остеопорозом и небольшими компрессионными переломами позвонков, лучше всего подвергается химиотерапии.
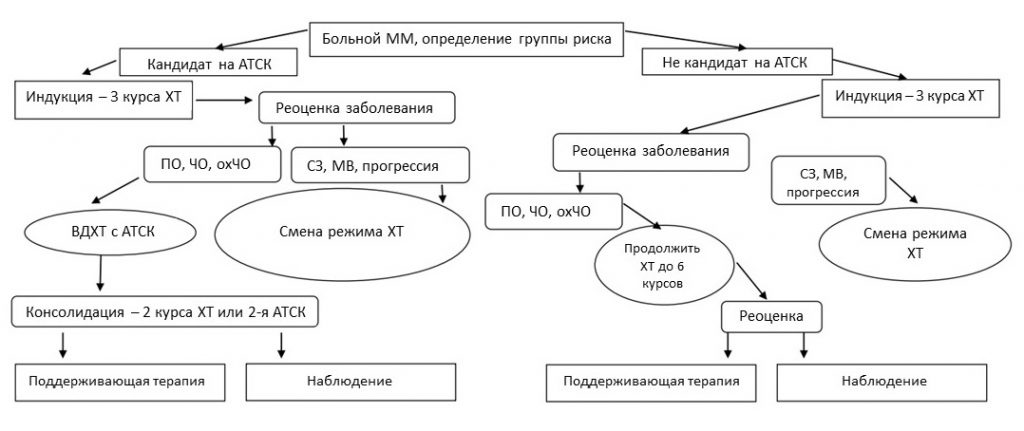
Алгоритм лечения больных множественной миеломой
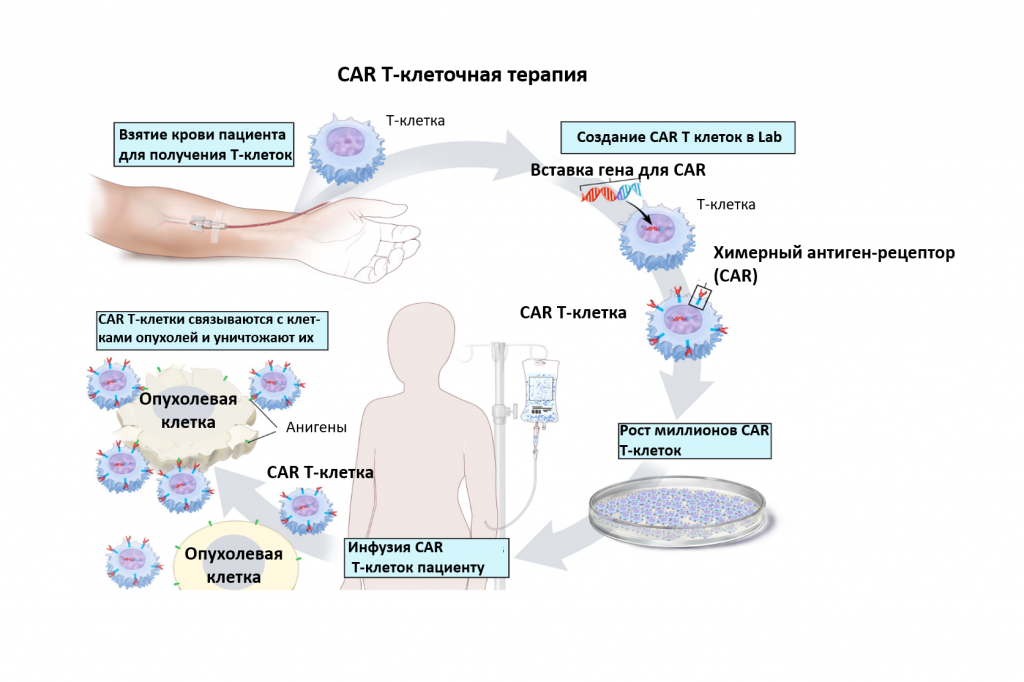
Т-клеточная терапия CAR
Т-клеточная терапия CAR: это лечение изменяет Т-клетки пациента (тип клеток иммунной системы), чтобы они атаковали определенные белки на поверхности раковых клеток. У пациента берут Т-клетки и в лаборатории на их поверхность добавляют специальные рецепторы. Измененные клетки называют Т-клетками рецептора химерного антигена (CAR). Т-клетки CAR выращивают в лаборатории и пациенту вводят путем инфузии. Т-клетки CAR размножаются в крови пациента и атакуют раковые клетки.
Т-клеточная терапия CAR изучается для лечения множественной рецидивирующей миеломы.
Зарегистрируйтесь на нашем сайте прямо сейчас, чтобы иметь доступ к большему количеству обучающих материалов!
Подписаться на наши страницы:
Источники:
- Bradford A. Curt, Charles Kuntz, IV, Ferhan A. Asghar Differential Diagnosis and Initial Management Spine Pathology
- Frederick R. Singer Paget’s Disease of Bone
- https://www.healthdirect.gov.au/pagets-disease-of-bone
- NCCN Guidelines
- Oi Lin Lee, Noemi Horvath, Cindy Lee, Doug Joshua, Joy Ho, Jeff Szer, Hang Quach, Andrew Spencer, Simon Harrison, Peter Mollee, Andrew W. Roberts, Dipti Talaulikar, Ross Brown, Bradley Augustson, Silvia Ling, Wilfrid Jaksic, John Gibson, Anna Kalff, Anna Johnston, Akash Kalro, Chris Ward, H. Miles Prince, Andrew Zannettino Bisphosphonate guidelines for treatment and prevention of myeloma bone disease
- P. Moreau, J. San Miguel, P. Sonneveld, M. Attal at al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up DOI:https://doi.org/10.1093/annonc/mdx096
- National Cancer Institute Plasma Cell Neoplasms (Including Multiple Myeloma) Treatment (PDQ®)
- Multiple myeloma
- Dimopoulos, Meletios A.; Moreau, Philippe; Terpos, Evangelos; Mateos, María-Victoria; Zweegman, Sonja; Cook, Gordon; Delforge, Michel; Hájek, Roman; Schjesvold, Fredrik; Cavo, Michele; Goldschmidt, Hartmut; Facon, Thierry; Einsele, Hermann; Boccadoro, Mario; San-Miguel, Jesús; Sonneveld, Pieter; Mey, Ulrich Multiple Myeloma: EHA-ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-up DOI: 10.1097/HS9.0000000000000528
- Aula Ramo, Cortney Mckay, Vrushali Dabak Cardiac Considerations With Carfilzomib in a Patient Diagnosed With Multiple Myeloma
- Laura Rosiñol, Albert Oriol, M Jesús Blanchard, Luis Palomera, Maria-Victoria Mateos, Javier De La Rubia, Miguel T Hernandez, Joaquín Díaz-Mediavilla, Jose Mariano Hernandez, Raquel Jiménez, Cristina Motllo, Juan José Lahuerta, Jesus F. San Miguel, Joan Blade Tumor and Renal Response in Patients with Newly Diagnosed Multiple Mieloma and Renal Failure Treated with Bortezomib and Dexamethasone: Results of a Prospective Phase II Trial from Pethema/GEM https://doi.org/10.1182/blood.V124.21.4776.4776
- https://empendium.com/ua/chapter/B27.II.15.15
Диагностические критерии множественной миеломы – Онлайн калькулятор
Пересмотренная международная система стадирования множественной миеломы (R-ISS) – Онлайн калькулятор
Пересмотренная международная система стадирования множественной миеломы (R-ISS) – Онлайн калькулятор – инструмент прогнозирования для пациентов…
Международная система стадирования множественной миеломы (ISS) – Онлайн калькулятор
Международная система стадирования множественной миеломы (ISS) прогнозирует тяжесть множественной миеломы на основе обычно получаемых лабораторных…
Шкала SAVED для стратификации риска ВТЭ
Шкала SAVED для стратификации риска венозной тромбоэмболии у пациентов с множественной миеломой, получающих иммуномодуляторы. ПеременнаяБаллыОперативное…
Шкала IMPEDE для стратификации риска ВТЭ
Шкала IMPEDE для стратификации риска венозной тромбоэмболии у пациентов с множественной миеломой, получающих иммуномодуляторы. Индивидуальные…
IPSET – риск тромбоза для эссенциальной тромбоцитемии: онлайн калькулятор
Международная прогностическая оценка тромбоза при эссенциальной тромбоцитемии (ЭТ) Всемирной организации здравоохранения (IPSET-thrombosis – International Prognostic…